- Autora Stanley Ellington [email protected].
- Public 2023-12-16 00:14.
- Última modificació 2025-01-22 15:54.
Aldehids , Cetones , i Àcids carboxílics Són compostos carbonílics que contenen un doble enllaç carboni-oxigen. Aquests compostos orgànics són molt importants en el camp de la química orgànica i també tenen moltes aplicacions industrials.
En conseqüència, quina diferència hi ha entre un aldehid, una cetona i un àcid carboxílic?
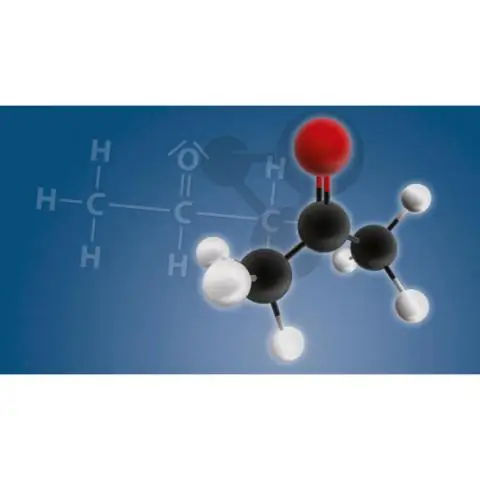
Aldehids i cetones conté el grup funcional carbonil. En un aldehid , el carbonil es troba al final d'una cadena de carboni, mentre que en una cetona , és en el mig. A àcid carboxílic conté el grup funcional carboxil. En un èster, l'hidrogen d'a àcid carboxílic el grup és substituït per un grup alquil.
Quina és la prova d'identificació de l'aldehid cetona i l'àcid carboxílic? Tollens' Prova . Tollens' prova , també conegut com a mirall de plata prova , és un laboratori qualitatiu prova s'utilitza per distingir entre un aldehid i a cetona.
A més, l'aldehid és un àcid carboxílic?
A àcid carboxílic és on l'oxigen d'un èster s'enllaça amb un hidrogen. Aldehid és una cetona on un dels enllaços del carboni és un hidrogen. Les amines es compliquen perquè n'hi ha de 3 tipus, primàries, secundàries i terciàries. El primer és un grup NH2.
Quin és més àcid aldehid o àcid carboxílic?
Àcids carboxílics generalment tenen pKas en el rang de 3 a 5 i, per tant, són més febles àcids que l'ió hidroni (H3O+), però són més forts àcids que altres orgànics àcids , com ara alcohols (16 - 20), aldehids i cetones (18 - 22), alquins (25), benzè (35) o alcans (50).
Recomanat:
Què són els àcids forts i dèbils expliquen amb exemple?

Els àcids forts es dissocien (es trenquen) completament a l’aigua). Per exemple, HCl, un àcid fort es trencarà en ions H + i Cl-. Els àcids febles es dissocien parcialment a l’aigua. Per exemple, l'HF, un àcid feble, només tindrà algunes de les molècules d'HF dissociades en un moment donat
Els àcids febles tenen pKa alt o baix?

001) = -3 de manera que pKa = 3. Així, com més gran sigui pKa, més petit serà Ka, i això significa un àcid més feble
Els àcids carboxílics són èsters?
Un èster d'àcid carboxílic és un èster derivat d'un àcid carboxílic, que té la següent fórmula estructural general. ex.: El grup O=C-O en un èster d'àcid carboxílic s'anomena grup èster d'àcid carboxílic. Els èsters d'àcid carboxílic són els més comuns en química orgànica
Per què els àcids forts tenen pKa baix?

Un pKa més baix significa que el valor de Ka és més alt i un valor de Ka més alt significa que l'àcid es dissocia més fàcilment perquè té una concentració més gran d'ions hidroni (H3O+)
Per què els àcids febles són febles?

Un àcid és feble si no totes les molècules d'àcid s'ionitzen en protons d'hidrogen i la seva base conjugada en un sistema de dissolvent particular. Alternativament, si utilitzem la definició de Brønsted més àmplia, un àcid és feble si no dona completament o gairebé completament el seu protó a alguna base
